
帕金森病(PD)是一种神经退行性疾病,其特征是进行性运动障碍并伴有非运动症状。PD的神经病理学标志是主要分布在黑质致密部中的多巴胺能神经元的损失和主要由α-突触核蛋白(α-synuclein,α-Syn)组成的细胞内包涵体——路易小体(LBs) 的产生。基于PD患者死后大脑中 α-Syn 病理学的分布和进展模式的详细分期显示α-Syn与临床表型相关。来自细胞和动物研究的累积证据表明,α-Syn的聚集促进了α-Syn病理在大脑中的解剖扩散。本文简要介绍了α-Syn在PD研究中的起始和进展,以及正在研究的各种靶向α-Syn的治疗策略,同时明确了在发现和开发治疗 PD 的治疗方法方面的挑战和机遇。

α-Syn首次与PD联系在一起是在1997年,当时在一个名为Contursi的意大利大家族和三个希腊血统的常染色体显性早发PD家族中发现了其编码基因(SNCA)的错义突变(A53T)。不久之后,免疫染色显示α-Syn是路易小体(LBs)的主要成分,路易小体是神经元内细胞质包涵体,长期以来一直被认为是PD的标志性病理特征。在非家族性PD患者的黑质以及路易小体痴呆(DLB)患者的扣带回皮层和黑质中检测到α-Syn聚集的证据,表明α-Syn与神经退行性疾病之间存在关联,而不仅仅是罕见基因突变的个例。事实上,在绝大多数散发性帕金森病患者中都存在病理性α-Syn聚集。自20世纪90年代末的这些开创性发现以来,又出现了几次错义突变以及SNCA基因位点的倍增与早发、常染色体显性帕金森病和痴呆症有关。此外,在散发性PD患者的大脑中检测到SNCA的表观遗传沉默减少,再次表明α-Syn的表达水平是PD发病的重要决定因素。与此一致的是,PD患者脑脊液(CSF)中的α-Syn水平发生改变,总α-Syn降低,但其寡聚体、磷酸化和聚集形式增加。

α-Syn 最初是从 AD患者 脑的淀粉样蛋白斑块中分离出来的,作为一种称为老年斑非 Aβ 组分 (NACP) 前体的片段。它广泛表达于不同的大脑区域,包括新皮层、海马、齿状回、嗅球、丘脑、小脑、杏仁核和伏隔核,并且主要位于突触前末端。在结构上,α-Syn 可分为三个核心区域,横跨整个 140 个氨基酸长度:(1)两亲性 N 末端区域,残基 1-60;(2) 疏水中心非 Aβ 组分 (NAC) 部分,残基 61-95;(3) 酸性 C 末端区域,残基 96-140。
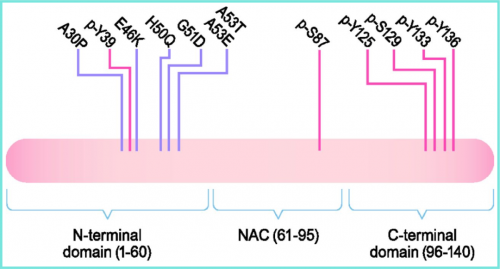
α-Syn的结构。α-Syn是一种140个氨基酸(aa)的蛋白质,由三个结构域组成:N端结构域(aa 1-60)、NAC结构域(AA61-95)和C端结构域。在NAC和N末端结构域中发现了11个重复7次的残基序列。这些重复序列在与脂质结合时呈现两亲性α-螺旋二级结构,介导α-Syn与脂质膜的相互作用。所有已知的疾病相关突变都在N端结构域中发现。疾病相关突变以紫色标记,磷酸化位点以红色标记。
α-Syn在生理上处于胞质未折叠单体状态和膜结合α-螺旋状态之间的动态平衡。在触发聚集的病理相关条件下,α-Syn单体从其天然未折叠状态转变为寡聚中间体和原纤维,然后转变为富含特征性β-折叠结构和交叉β-构象的淀粉样原纤维,随后沉积到路易小体中。体外实验表明,α-Syn的原纤维化过程是可逆的,因为在没有单体的情况下α-Syn原纤维会分解成寡聚体。与无毒寡聚体相比,毒性寡聚体通常富含β折叠结构,并暴露出更多的疏水残基,使它们能够渗透膜并造成细胞损伤,这是毒性α-Syn寡聚体被认为具有神经毒性的主要原因。阻碍寡聚体从原纤维中释放可以防止其毒性。虽然寡聚体与神经元功能障碍有关,但原纤维可以从一个细胞传播到另一个细胞,这意味着在原纤维生长过程中形成的每个聚集物在PD进展中起着不同的作用。
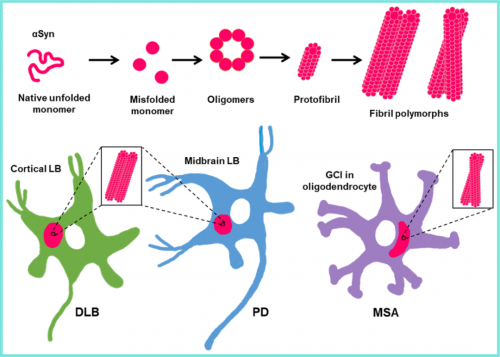
α-Syn的原纤维形成途径以及不同的α-Syn原纤维如何引起了不同的病理表型。α-Syn的错误折叠可导致其从天然未折叠状态转变为低聚物中间体和原纤维,然后转变为淀粉样纤维,其在棒状(非扭曲丝)和扭曲丝(扭曲丝)形式中表现出多态性,最终在帕金森病(PD)和伴有路易小体的痴呆中观察到路易小体(LB)的形成,以及在多系统萎缩(MSA)中观察到的胶质细胞质内含物(GCI)。

α-Syn的正常生理功能尚未完全阐明,但它富含突触前室,可与囊泡和膜结合。α-Syn除了在突触前神经元末端与突触小泡直接相互作用外,还与突触蛋白相互作用,如磷脂酶D2和小分子GTP酶Rab。在细胞和动物模型中检查α-Syn过表达或表达降低后的突触内稳态研究表明它与神经递质释放、突触活动和可塑性的调节有关。尽管可以构建SNCA基因敲除动物模型,但它们在突触小泡的运输中表现出与过表达模型相似的功能障碍。

对PD患者脑中α-Syn聚集的系统神经病理学研究表明,其病理学的进展和传播模式与疾病的临床进展相对应。Braak分期系统支持这样一种观点,即在PD的早期阶段,α-Syn的沉积见于前嗅核、迷走神经背侧运动核、外周自主神经节。随着时间的推移,这些聚集物扩散到脑干、皮质和边缘区。有证据表明,α-Syn在肠道中沉积,并可能从外周神经系统(PNS)传播到中枢神经系统(CNS),这与帕金森病症状发展的时间序列相一致。虽然帕金森病的神经退行性变过程对大脑区域有显著影响,并且该疾病的许多典型运动表现都来自黑质致密部,但许多患者在运动症状出现前几年就出现了大量非运动症状,包括快速眼动睡眠行为障碍、嗅觉减退、便秘、焦虑和抑郁。据此推测,前驱期的治疗干预可能会阻止或延迟帕金森病的进展,即延缓发展为致残性运动症状并最终导致认知障碍。在脑脊液和血浆中检测到α-Syn的早期研究表明,这种致病性的α-Syn能够从神经元中释放出来。但2008年首次发现了α-Syn在人脑中细胞间传播的证据,健康人胚胎中脑移植物移植到PD患者纹状体后,该PD患者尸检研究显示,原本健康的中脑移植物,在移植后4至24年间出现α-Syn-阳性路易小体病变。α-Syn细胞间传递的机制仍在研究中。
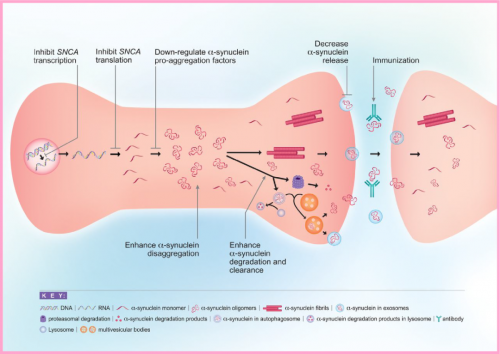
降低α-Syn毒性的方法。在α-Syn的生命周期中存在多个点,可以使用治疗剂干预其毒性。包括减少α-Syn转录或翻译,通过使用解聚剂抑制α-Syn聚集,或干扰促聚集因子,通过自噬或泛素-蛋白酶体系统增强α-Syn清除和降解,减少α-Syn释放到细胞外空间,以及通过免疫方法靶向病理性α-Syn。

对α-Syn组装模式和跨神经元扩散的理解为新的治疗方法提供了理论基础。主动和被动免疫疗法都已被广泛研究,并显示可减少动物模型中的α-Syn病理。最近,小分子聚集抑制剂在临床前模型中显示出良好的疗效。致病性组装体的摄取或清除的一般机制也可能适用于靶向治疗。目前研究的预防和减轻PD中α-Syn毒性的各种方法包括使用免疫策略从脑中清除其病理聚集物,抑制其错误折叠和聚集,降低其表达水平,增强细胞清除机制,防止其在脑内和可能从外周的细胞间传递等。到目前为止,已经用两种抗α-Syn抗体在人类中进行了II期临床试验:Prasinezumab(PRX002),一种结合α-Syn C末端的人源化小鼠单克隆抗体9E4,和Cinpanemab(BIIB054),一种与α-Syn N末端结合的人源性抗体。两种抗体均与聚集的α-Syn结合,但尚不清楚两者是否与疾病相关的α-Syn种类结合,这种致病性的α-Syn被认为是导致病理进展的重要原因。尽管两种抗体治疗均未达到主要疗效结果,但prasinezumab显著减缓了运动功能的下降,使数字运动评分下降25-30%,症状更严重和进展更快的患者从治疗中受益最大。基于这些令人鼓舞的发现,一项针对症状更严重的帕金森病患者的IIb期研究(PADOVA)已经启动并将持续到2023年。这些疗法发展的一个主要限制是缺乏测量CSF或大脑中靶点参与的生物标志物。目前没有可用于α-Syn聚集体的PET配体,但通过冷冻电子显微镜对其结构的解析可能会有所帮助。CSF中的α-Syn接种试验显示PD诊断的敏感性和特异性为80-90%,两种试验类型之间存在高度重叠。

自从首次发现α-Syn是散发性PD中路易小体的主要成分,并鉴定了罕见家族形式的SNCA突变以来,其在人类疾病中的作用逐渐被揭示。在转基因或病毒过表达动物模型中的早期研究表明,其致病性源于错误折叠的α-Syn的毒性功能增强,这种毒性增强最有可能始于突触。目前正在寻求多种方法来开发直接或间接影响α-Syn的PD疾病修饰疗法,近年来也取得了实质性进展。然而,仍然没有证实这些疗法在减缓PD致残状态的进展方面是安全有效的。究其原因,首先,帕金森病的发病机制是复杂的且尚未完全阐明,很难预测到致病途径中的理想靶点。疾病的异质性,多种遗传原因和风险,某些基因的可变外显率,以及不同的临床病程和病理变化进一步加剧这种复杂性。此外,目前没有可用的动物模型能够真实地再现人类PD的发病机制。因此,临床前试验中观察到的治疗效果可能无法代表药物在患者中的疗效。PD治疗开发和测试的另一个挑战是缺乏可靠的前驱期PD和疾病进展的生物标志物。个体之间症状进展的可变性增加了选择临床试验候选人和评估药物疗效的挑战。此外,通常很难确定和招募前驱期患者,通常需要在症状出现之前启动试验,因为此时治疗可能更有效。目前正在采取多项举措开发PD生物标志物。但人们认识到,对大脑中α-Syn聚集体的成像能力存在着迫切的需求,并且正在朝着这一目标进行努力。此外,正在研究CSF α-Syn聚集物、血清外泌体α-Syn水平和血液神经丝轻链的组合,以用于PD诊断、预测和治疗,但需要在大量、独立的同系物中进行进一步验证。通过验证疾病的生物标志物,特别是病理性α-Syn沉积,将大大提高我们识别疾病运动前阶段高危个体的能力,并采用有效和安全的治疗方法进行干预,以防止疾病发展为临床表现疾病。尽管存在挑战,但今天为 PD 寻找改善疾病的治疗方法的前景比以往任何时候都更加现实。我们对疾病的更好理解、干预的创新理念、生物技术的进步、正在测试的多种方法以及成像和其他生物标志物的新发展将使这一目标成为可能。
参考文献:
1.Jasutkar H G, Oh S E, Mouradian M M. Therapeutics in the Pipeline Targeting α-Synuclein for Parkinson's Disease[J]. Pharmacological Reviews, 2022, 74(1): 207-237.
2.Tofaris G K. Initiation and progression of α-synuclein pathology in Parkinson’s disease[J]. Cellular and Molecular Life Sciences, 2022, 79(4): 1-11.
3.Choong C J, Mochizuki H. Neuropathology of α‐synuclein in Parkinson's disease[J]. Neuropathology, 2022, 42(2): 93-103.
文案 | 灵犀
排版 | 周琦
审核 | 李迪迪 刘泽鹏


版权声明:
1、凡本网注明"来源:百年健康网 电/讯"或带有百年健康网LOGO、水印的所有文字、图片和音频视频稿件,版权均属百年健康网所有,任何媒体、网站或单位和个人未经本网书面授权不得转载、链接、转贴或以其他方式复制发表。
2、已经本网书面授权使用作品的媒体、网站,应在授权范围内使用,并注明“来源及作者”。违反上述声明者,本网将依法追究其相关法律责任。











